疫学研究において、最も信頼性が高いといわれる「ランダム化比較対照試験」とは、どういう研究方法なのでしょうか。今回は、高い信頼性を担保するためにとられている手法と、その理論的背景を解説していただきました。世にあふれる医療情報を読み解くためにも、スタンダードとなる知識のベースをこの機会にぜひ。[編集部]
前回は、ファイザー社のワクチンに関する『ニュー・イングランド・ジャーナル・オブ・メディシン(NEJM)』論文の概要と意義を解説した。この研究は、ランダム化比較対照試験と呼ばれる研究デザイン(研究方法)を採用している。今回は、理論編の1回目として、ランダム化比較対照試験の概略について説明する。
いまたとえば、「ファイザー社mRNAワクチンのCovid-19発症に対する有効性を評価する」というテーマで、研究を計画することを考えるとしよう。このとき、おなじテーマの研究であっても、研究者が採用できる研究方法は1つだけではない。複数の研究方法が存在する。この複数の研究方法を、研究デザイン(study designs)と呼ぶ。「デザイン」というと、洋服や自動車の見かけとしての「デザイン」を思い起こすが、この場合は「設計図」くらいの意味である。研究者は、複数の設計図の中から1つを選んで、研究を計画する。
図表4-1に、代表的な研究デザインを示す。また、これらの研究デザインで用いられる主要な8つの構成要素も示す。8つの構成要素は、研究デザインという「設計図」を組み立てる際の、「部品」に相当する。研究デザインによって、使われる部品と使われない部品がある。逆に言えば、使われる部品の違いによって、研究デザインの違いが生ずることになる。
ランダム化比較対照試験は、薬剤や手術などの治療法や、ワクチンやがん検診などの予防法の有効性と安全性を評価するための研究デザインの1つである。図表4-1に示すように、研究デザインのおもな8つの構成要素(部品)が、すべて使われている。
ランダム化比較対照試験は、つぎの8つの部品をすべて使った、フルスペックの研究デザインともいえる。①「対象者の選択」、②対象者の「ランダム化」、③「対照群」の設定、④「介入」、⑤「追跡調査」、⑥「健康アウトカムの有無の確認」、⑦「健康アウトカムの頻度の算出」、⑧相対リスクなどの「関連性の指標の算出」。このため、各種の研究デザインの中でも、結果の信頼性はもっとも高いと一般に考えられている。
ランダム化比較対照試験は、Randomized Controlled Trialと英語表記され、RCTと略される。”Randomized”は対象者のランダム化を指し、”Controlled”は対照群を設定することを意味する。”Trial”は臨床試験のことである。つまりRCTは、「対象者をランダム化して」「対照群を設定する」「臨床試験」を意味する。
図表4-2に、8つの部品を用いてどのようにランダム化比較対照試験が行われるか、その流れを示す。
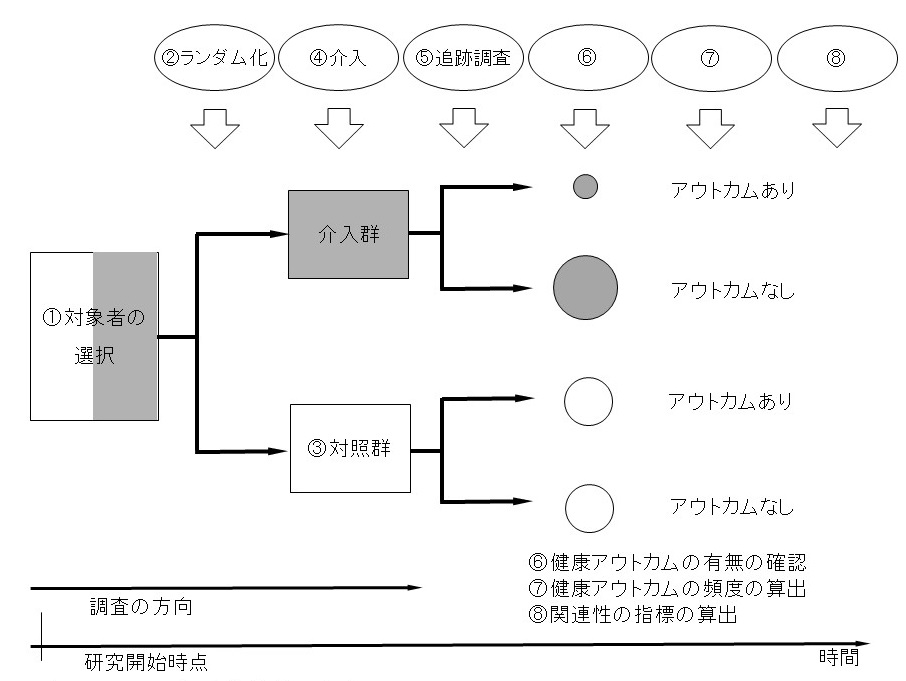
①対象者の候補の中から、適格基準と除外基準を用いて、条件にあった「対象者の選択」を行う。②選び出された対象者を「ランダム化」して2群に分け、介入群と③「対照群」を設定する。介入群には、当該の研究で評価しようとしている④「介入」(治療法や予防法)を行なう。いっぽうの対照群には、この研究で評価しようとしている介入は行わず、プラセボ(偽薬、後述)の投与や通常の治療法や予防法を行う。
つづきは、単行本『疫学 新型コロナ論文で学ぶ基礎と応用』でごらんください。
 世界的な業績のある疫学者が、新型コロナ論文を題材に疫学の基礎から応用をわかりやすく解説。基本用語から最先端技法まで網羅する!
世界的な業績のある疫学者が、新型コロナ論文を題材に疫学の基礎から応用をわかりやすく解説。基本用語から最先端技法まで網羅する!
※「まえがき」と「あとがき」をたちよみできます。⇒【たちよみはこちら】
2021年12月22日発売
坪野吉孝 著 『疫学 新型コロナ論文で学ぶ基礎と応用』
A5判並製・240頁 本体価格2700円(税込2970円)
ISBN:978-4-326-70121-6 →[書誌情報]
【内容紹介】 ランダム化比較対照試験、前向きコホート研究、症例対照研究など、疫学で使われる研究デザインとは? 世界を代表する医学専門誌に掲載された新型コロナ論文を読み解きながら、疫学の考え方を非医療者も理解できるようわかりやすく解説する。データと論理と知性の力によって無数の人々の生命を救う、疫学の成果と課題を知るために。
【目次】
まえがき
Ⅰ 基礎編――疫学の基本事項
1 疫学とは
2 疾病頻度の指標
3 関連性の指標
4 因果性の競合的解釈
5 偶然
6 バイアス
7 交絡
8 研究デザイン
9 ランダム化比較対照試験
10 前向きコホート研究
11 後向きコホート研究
12 症例対照研究
13 地域相関研究と時系列研究
14 システマティック・レビューとメタアナリシス
Ⅱ 応用編――新型コロナの疫学論文を読み解く
1 ランダム化比較対照試験[ワクチン]
「これは勝利である」――ファイザー社mRNAワクチンの有効性
2 後向きコホート研究[ワクチン]
リアルワールドエビデンスの「マジック」――イスラエルの集団接種
3 前向きコホート研究[ワクチン]
Covid-19ワクチンによる「発症」予防と「感染」予防
4 症例対照研究[ワクチン]
急速に蔓延するデルタ株との闘い
5 後向きコホート研究[治療]
コロナ時代の最初の巨大な研究スキャンダル――血圧降下薬・ヒドロキシクロロキン・イベルメクチン
6 ランダム化比較対照試験[治療]
パンデミックの時こそ、緊急性と科学性を両立させる――デキサメタゾン
あとがき
索引
連載はこちら》》》コロナ時代の疫学レビュー


